[1] XUHONG J C, QI X W, ZHANG Y, et al. Mechanism, safety and efficacy of three tyrosine kinase inhibitors lapatinib, neratinib and pyrotinib in HER2-positive breast cancer [J]. American Journal of Cancer Research, 2019, 9(10): 2103-19.
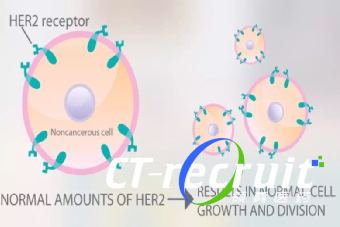
[2] 马心迪, 张香梅, 刘运江. HER2低表达乳腺癌诊断和治疗研究进展 [J]. 中华肿瘤防治杂志, 2022, 29(12): 7.
[3] 王怡红, 魏妍, 梁裕华, et al. HER2抑制剂研究现状及耐药机制研究 [J]. 海峡药学, 2021,
[4] YU X, HARDEN K, C GONZALEZ L, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells [J]. Nature Immunology, 2009, 10(1): 48-57.
[5] BOLES K S, VERMI W, FACCHETTI F, et al. A novel molecular interaction for the adhesion of follicular CD4 T cells to follicular DC [J]. European Journal of Immunology, 2009,
[6] ANDERSON A C, JOLLER N, KUCHROO V K. Lag-3, Tim-3, and TIGIT: Co-inhibitory Receptors with Specialized Functions in Immune Regulation [J]. Immunity, 2016, 44(5): 989-1004.
[7] FOURCADE, JULIEN, MAURER, et al. TIGIT and PD-1 impair tumor antigen-specific CD8(+) T cells in melanoma patients [J]. The Journal of Clinical Investigation: The Official Journal of the American Society for Clinical Investigation, 2015, 125(5): 2046-58.
[8] JOHNSTON ROBERT J, COMPS-AGRAR L, HACKNEY J, et al. The Immunoreceptor TIGIT Regulates Antitumor and Antiviral CD8+ T Cell Effector Function [J]. Cancer Cell, 2014,
[9] LI Y C, ZHOU Q, SONG Q K, et al. Overexpression of an Immune Checkpoint (CD155) in Breast Cancer Associated with Prognostic Significance and Exhausted Tumor-Infiltrating Lymphocytes: A Cohort Study [J]. Journal of Immunology Research, 2020, 2020(1-9.
[10] MA W, MA J, LEI T, et al. Targeting immunotherapy for bladder cancer by using anti-CD3 × CD155 bispecific antibody [J]. Journal of Cancer, 2019, 10(21):
[11] 朱珠, 郑珩. 免疫检查点TIGIT在肿瘤中的研究进展 [J]. 药学进展, 2023, 47(3): 8.
[12] MORIN L N J. The claudins [J]. Genome Biology, 2009,
[13] TÜRECI Z, KOSLOWSKI M, HELFTENBEIN G, et al. Claudin-18 gene structure, regulation, and expression is evolutionary conserved in mammals [J]. Gene, 2011, 481(2): 83-92.
[14]TAKASAWA K, TAKASAWA A, OSANAI M, et al. Claudin-18 coupled with EGFR/ERK signaling contributes to the malignant potentials of bile duct cancer [J]. Cancer Letters, 2017, 66.
[15] SAHIN U, KOSLOWSKI M, DHAENE K, et al. Claudin-18 splice variant 2 is a pan-cancer target suitable for therapeutic antibody development [J]. Clinical Cancer Research, 2008, 14(23): 7624-34.
[16] 陈彬羽, 沈凯誉, 高文仓. 靶向CLDN18.2实体瘤治疗药物的研究进展 [J]. 浙江医学, 2023, 45(1): 5.
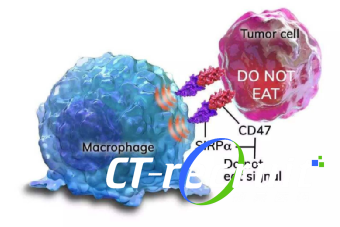
[17] BROWN E J, FRAZIER W A. Integrin-associated protein (CD47) and its ligands [J]. Trends in Cell Biology, 2001, 11(3): 130-5.
[18] A., NEIL, BARCLAY, et al. The Interaction Between Signal Regulatory Protein Alpha (SIRPot) and CD47: Structure, Function, and Therapeutic Target [J]. Annual Review of Immunology, 2014, 32(25-50.
[19] HONGQIAN. CD47免疫功能与靶向药物的研究进展 [J]. 军事医学, 2020, 44(1): 0-.
[20]KHOCHBIN S. When are the BET factors the most sensitive to bromodomain inhibitors? [J]. Transcription, 2013,
[21] FANG W U, YONGCHANG Z, KUNYAN L I, et al. BRD4抑制剂抗肿瘤机制研究进展 [J]. 肿瘤药学, 2019, 9(2): 7.