晚期胃癌治疗停滞的十年,PD-1抑制剂能否逆转?
肿瘤复发找领募 400-699-8889
胃癌发病率居全球第5位,死亡率居全球第4位。全球每年新发胃癌病例超过100万例,中国约占其中的40%,严重威胁人类健康[1]。
由于胃癌症状无特异性,胃镜作为常规筛查普及率低,我国约1/3患者确诊时即为晚期[2]。
免疫检查点抑制剂是当今肿瘤治疗领域的重大突破,程序性死亡受体-1(programmed death-1,PD-1)单抗在胃癌三线及以上治疗中的作用已被肯定并纳入指南推荐[3, 4]。
因此,本研究拟探讨PD-1单抗在胃癌晚期中的治疗进展情况。
图片源自网络
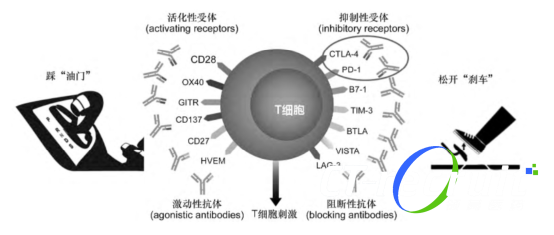
正常机体中T细胞表达的PD-1受体与其配体PD-L1和程序性死亡配体2 (programmed death ligand 2, PD-L2) 结合,可以抑制T细胞增殖和细胞因子生成。
部分肿瘤细胞的PD-1配体上调,通过这个通路信号传导可抑制激活的T细胞对肿瘤的免疫监视,导致肿瘤的发生和转移。
PD-1抑制剂可与PD-1受体结合,阻断其与PD-L1和PD-L2之间的相互作用,阻断PD-1通路介导的免疫抑制反应,包括抗肿瘤免疫反应。
在同源小鼠肿瘤模型中,阻断PD-1活性可抑制肿瘤生长[5],其作用机制如图所示:
目前临床研究较多的PD-1/ PD-L1抑制剂有帕博利珠单抗 (pembrolizumab)、纳武单抗(nivolumab)。
帕博利珠单抗已被美国FDA批准用于PD-L1阳性即联合阳性分数(combined positive score,CPS)≥1分的复发性局部晚期或转移性胃或胃食管结合部腺癌的三线治疗。
2015 年发布的一项国际多中心临床研究KEYNOTE-012中[7],PD-L1阳性的晚期胃癌患者接受帕博利珠单抗治疗直至疾病进展或发生不可耐受的不良反应事件。
在最终纳入治疗组的39例晚期胃癌患者中:
32例患者在使用免疫治疗后至少有1次评估过肿瘤大小,其中17例(53%)发生了肿瘤退缩;
36例可评估疗效的患者中,8例(22%)确认获得影像学部分缓解,4例(11%)患者直到报告结果时未发生进展;
该研究的中位反应时间为40周,亚洲和非亚洲地区的结果一致。
该研究证明了免疫抑制剂疗法可以应用于胃癌患者的治疗,从而叩开了免疫抑制剂在胃癌研究中的大门。
KEYNOTE-059中一项针对日本和欧美人群的随机II期临床研究[8],该研究中帕博利珠单抗单药被用于既往经过二线或以上化疗的胃或胃食管结合部腺癌患者。
最终PD-L1阳性(CPS≥1)者客观缓解率达15.5% [95%CI(10.1%,22.4%)],中位持续缓解时间为16.3个月,免疫抑制剂治疗在此研究中表现出良好的疗效。
得益于此研究,帕博利珠单抗已被美国FDA批准用于PD-L1阳性(CPS≥1 分)复发性局部晚期或转移性胃或胃食管结合部腺癌的三线治疗。

纳武利尤单抗注射液俗称O药,是我国批准上市的首个以PD-1为靶点的单抗药物。
该药物由美国百时美施贵宝公司研制开发,并于2018年6月15日在国内获批上市,为一种针对PD-1受体的人源化单抗(Ig G4亚型),结合区域为N环[9]。
纳武单抗在韩国等国家被批准可以应用于晚期胃或胃食管交界处肿瘤的三线治疗,此是基于ATTRACTION-2[3]研究的阳性结果。
其研究结果显示,亚洲地区既往接受过二线及二线以上治疗的胃或胃食管交界处肿瘤患者中,接受纳武单抗治疗组相比安慰剂组的总生存期显著延长,1年以上患者生存率分别为27%和11%(HR=0.63,P<0.000 1)。
此阳性研究结果无疑为胃癌免疫治疗提供了强有力的依据。
纳武利尤单抗于2020年成为第1个在国内获批用于胃癌治疗的免疫检查点抑制剂,备受医疗及科研工作者的关注。
纳武单抗单药或联合经典胃癌抗肿瘤方案治疗晚期胃癌均取得了可喜的成果,值得持续关注及进一步研究。

PD-1/PD-L1的单抗在肿瘤免疫治疗中应用正成为研究热点,但对于其他新的免疫检验点进行的研究仍在进行。
活化T细胞、NK细胞及B细胞上的免疫抑制检验点分子淋巴细胞活化基因3(LAG-3)以及NK细胞表面的杀伤抑制受体KIR等,可能成为下一代免疫抑制剂的分子靶点[10-12]。
关于胃癌的项目,her-2阳/her-2阴…初治、难治患者都可以免费咨询报名新药临床,用药有CLDAN18.2的CAR-T治疗、免疫、靶向…咨询可以联系我们。
(向下滑动查看全部)