肺癌是发病率和病死率最高的恶性肿瘤之一,每年全球约有159万患者死于肺癌。非小细胞肺癌(NSCLC)肺癌中最主要的组织类型,约占85%。
随着肺癌精准治疗时代的到来, NSCLC的治疗方案由传统的化疗发展为基于患者基因分子改变的个体化治疗,包括分子靶向治疗、抗血管治疗和免疫治疗等等[1]。
在晚期NSCLC患者中,腺癌患者驱动基因突变率高达64%[2],常见的驱动基因有表皮生长因子受体(EGFR),间变性淋巴瘤激酶(ALK),间质上皮转换因子(MET)等等[3]。
免疫治疗对驱动基因阴性晚期NSCLC患者具有显著疗效,但其对驱动基因阳性患者的疗效仍有争议,本文就驱动基因阳性的晚期非小细胞肺癌可否使用免疫治疗以及采取何种治疗方案展开综述。

图片源自网络
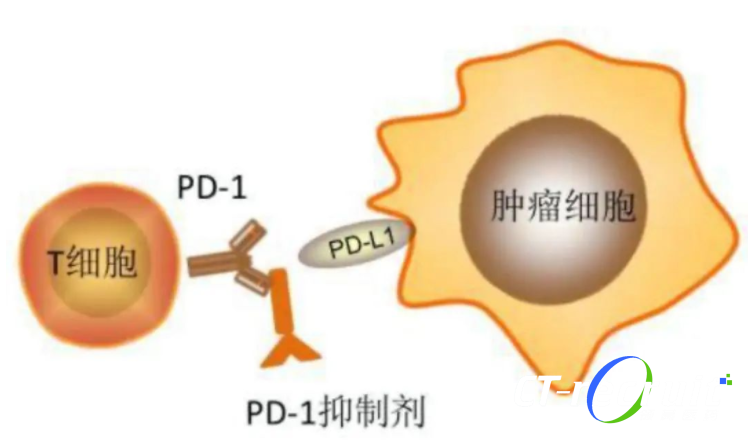
肿瘤细胞PD-L1与驱动基因的关系揭示免疫治疗的可能性
肿瘤细胞PD-L1表达是NSCLC和其他肿瘤ICIs疗效和预后相关的肿瘤标志物。
综合所有临床数据以及各项体内试验[4-9],目前关于EGFR突变和ALK融合与PD-L1表达之间的关系存在相矛盾的研究结果。
晚期NSCLC患者驱动基因阳性,靶向治疗一般是治疗的首选,其可以延长肿瘤患者的生存期。
针对驱动基因阳性的晚期NSCLC,靶向治疗的应用受到细胞适应性和由此产生的耐药的限制,因此耐药后PD-L1表达上调为靶向治疗失败的患者提供了免疫治疗的可能性。
图片源自网络
迄今为止,EGFR酪氨酸激酶抑制剂(TKIs)被临床指南推荐为EGFR突变的NSCLC的最佳一线治疗方案,尽管使用EGFR-TKIs对EGFR突变患者有所获益,但不可避免地会在9~18个月出现获得性耐药[10]。因此,ICIs是否对EGFR-TKIs耐药后患者有效值得探讨。
1.单药治疗:尽管ICIs单药或联合化学药物治疗显著延长了一线或二线NSCLC患者的总生存时间,但在EGFR突变型患者中并没有显著的疗效。
例如,有研究[11]报道了帕博利珠单抗用于EGFR突变型并且PD-L1表达≥1%的NSCLC患者一线免疫治疗的作用,证实了EGFR突变患者单独免疫治疗失败。
以及一项Meta分析[12]提示,使用单药纳武利尤单抗、帕博利珠单抗或阿替利珠单抗与先前治疗的EGFR野生型患者相比,EGFR突变型人群没有显示出良好的疗效。
上述研究均显示EGFR突变患者应用免疫治疗没有获益。
图片源自网络
然而,ATLANTIC研究[13]显示了免疫治疗对于EGFR突变患者潜在的获益可能,度伐利尤单抗作用于EGFR突变/ALK阳性且PD-L1表达≥25%的74例患者时客观缓解率达到12.2%,但PD-L1表达<25%的患者ORR只有3.6%。
这可能提示在EGFR突变的患者中,PD-L1表达高的患者免疫治疗疗效更好,但仍要注意的是,在PD-L1表达≥25%的患者中,EGFR突变/ALK阳性患者ORR仍低于EGFR阴性/ALK阴性患者。
总的来说,ICIs单药治疗在EGFR突变晚期NSCLC患者中疗效欠佳,其可能与此类患者PD-L1表达低有关,但仍需进一步研究。
2.联合用药治疗:在一项Ⅱ期随机对照试验[14]中,探讨了帕博利珠单抗联合多西他赛对比多西他赛单药治疗铂基化疗后疾病进展的晚期NSCLC的有效性,其中在EGFR突变型患者中,联合用药相比于化疗来说,对ORR以及PFS均有改善。
在野生型患者中也显示出相似的结果。表明无论EGFR突变状态如何,在晚期NSCLC患者铂基化疗后疾病进展的患者中,帕博利珠单抗联合多西他赛治疗可改善ORR和PFS。
相关研究揭示了免疫联合化疗或抗血管生成治疗方案在二线治疗中的潜在作用。使用EGFR-TKIs联合ICIs治疗虽然可以增加EGFR突变患者的有效率,但是往往显示出较高的不良反应发生率(腹泻,皮疹,间质性肺病[15],3级大肠炎[16]等)。
不仅如此,ICIs和EGFR-TKIs序贯用药也与严重免疫相关不良事件(肺炎,结肠炎,肝炎等)的风险增加有关[17, 18]。
综上,EGFR突变患者并非免疫治疗的绝对优势人群,但也并不是免疫治疗的禁地。
免疫治疗单药对于少数PD-L1高表达的EGFR突变人群仍有临床获益;同时,ICIs联合化疗±抗血管治疗可能是EGFR突变患者的潜在临床治疗模式,但有待提供更多的临床证据支持。
约5%的NSCLC患者携带ALK重排[19],ALK-TKIs已证明其作为晚期ALK阳性NSCLC的一线治疗优势,然而,用这些药物治疗的患者最终会产生获得性TKIs耐药和肿瘤进展,除了ALK-TKIs之外的治疗方案选择仍然是一个关键问题。
在对手术切除的NSCLC样本进行流式细胞分析及定量RT-PCR分析后,发现在EML4-ALK阳性细胞系中,PD-L1的表面表达和PD-L1 mRNA的丰度>EGFR和ALK野生型细胞[20]。
在ALK重排肺腺癌中,PD-L1表达和CD8+T细胞或PD-1+CD8+T细胞浸润的频率更高[21]。同时一项回顾性研究[22]发现在ALK重排或EGFR突变患者中使用ICIs的ORR只有3.6%(1/28),而在ALK阴性/EGFR突变/未知状态的患者中,ORR达到23.3%(7/30)。ICIs单药对ALK突变患者并未显示出良好获益。
图片源自网络
关于ICIs在ALK阳性患者中疗效的研究几乎都是小样本或者亚组分析。ICIs单药对于ALK阳性患者没有显示出良好的疗效,而ICIs联合ALK-TKIs的治疗方案往往显示出较高的不良反应发生率。
ALK突变与PD-L1表达之间的关系也尚无定论。因此仍需要进一步研究来探讨ALK阳性患者更优的治疗选择。
大鼠肉瘤原癌基因(RAS)家族是癌症中最常见的突变癌基因家族之一,在RAS突变中KRAS是最常见的类型之一。
在西方国家,KRAS突变约占肺腺癌的30%,在亚洲占10%~15%[23]。虽然KRAS是最早发现的致癌因素之一,但有效的KRAS靶向治疗仍然难以实现。
在早期和晚期转移环境中,KRAS突变型肺癌的预后均较差,迫切需要针对KRAS驱动的NSCLC新型药物,ICIs是一种潜在的选择。
图片源自网络
相关学者系统评估[24]了KRAS突变与PD-L1表达之间的关系,发现KRAS突变型肿瘤较KRAS野生型肿瘤PD-L1阳性比例更高,为进一步确认KRAS突变与PD-L1表达之间的关系,分析231例手术切除标本中的PD-L1表达。
结果表明,KRAS突变组PD-L1强阳性细胞比例高于野生型组,KRAS突变状态与PD-L1表达呈正相关(P=0.037),KRAS突变肿瘤比KRAS野生型肿瘤也表现出更多的T细胞浸润(P=0.003)。
这可能解释了为何ICIs在KRAS突变患者中有明显获益。
不仅如此,有研究[25]表明,在致癌KRAS突变存在下,STK11/LKB1的丢失促进了白细胞介素-6(IL-6)产生,从而促进中性粒细胞产生,减少T细胞浸润,并与较高水平的T细胞衰竭标志物表达和PD-L1低表达有关,提示随着STK11的丢失,KRAS突变导致免疫耐药;
而KRAS-TP53共突变肿瘤具有高水平的CD8+TILs、高表达的干扰素依赖基因和干扰素诱导的PD-L1,因此免疫治疗疗效明显。
KRAS突变NSCLC患者可以从ICIs中获益,但因KRAS突变存在高度异质性,对不同的共突变亚型疗效不一致,仍需要对KRAS突变的免疫微环境进一步研究,以确定更合适的免疫治疗策略。
随着技术的发展,NSCLC患者中可检测到的活性基因突变越来越多,相关医学挑战接踵而至,相信通过新型免疫治疗药物的研发、不同免疫联合治疗方案的探索、获益人群的精准选择,将不断为患者带来更多获益。




















